| うつ病を防げ |
| 2010年4月8日(木曜日) |
| 2●製薬会社と研究者の関係 効果出た研究 多く発表 |
薬の効果を研究する場合、多くの施設の医師が共同で調査する。そのための研究費の申請を国や財団に申し出る。さらにそれを大学や病院の倫理委員会などに提出し、許可を得る。ついに米国では食品医薬品局(FDA)に案を提出し、許可を得る。そこで研究が始まり、その結果 はFDAに送られ、その後論文になる。
これだけ聞くと問題はなさそうだが、研究グループづくりに始まり、研究を提案する医師の薬剤の入手先はどうなっているか。
詳しく調べると、製薬会社から物品や寄付金、講演依頼、食事接待など、さまざまな便宜を得る可能性がある。米国マサチューセッツ総合病院での2003年から04年にかけての調査で、94%の医師が製薬会社からなんらかの便宜を得ていた。83%は食事の接待、78%は薬品の提供、35%は学会への出席経費を受け取り、28%はコンサルティングや講演、治験に患者を入れる経費を受け取っていた。
倫理委員会のメンバーはどうか。米国の100の大学などの施設に調査した結果 、97.2%が質問に答えた。36%の委員が一つ以上の製薬会社と関係があった。85.5%は彼らの決定に会社は関係していないと言うが、11.9%は時に影響したと述べた。2.4%は時々、0.2%はいつも影響を受けたという。
彼らのうち57.7%は「その関係を常に公表している」と言い、23.1%は「一度も公表していない」と言っている。残りの委員は「時々、公表している」だった。
|
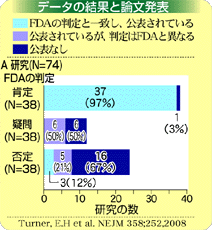
こうした関係はデータに影響しないのだろうか。企業から資金などを得ているからといって、データを改ざんするようなことはない。しかし「ぐあいの悪いデータは発表しない」ということはある。 計算するとFDAが「効果あり」としたものは、「効果なし」とした研究よりも12倍も公表されやすくなっていたのだ。 薬について効果があったものが論文になりやすく、そうでないものは発表されず、人々の目につかないということになる。 |
| Next |